提問者:卓於群而隱 | 瀏覽 次 | 提問時間:2017-08-29 | 回答數量:1
 沒有宏城市的說法,隻有化學方程式的說法。化學方程式,也稱為化學反應方程式,是用化學式表示化學反應的式子。化學方程式反映的是客觀事實。因此書寫化學方程式要遵守兩個原則:一是必須以客觀...
沒有宏城市的說法,隻有化學方程式的說法。化學方程式,也稱為化學反應方程式,是用化學式表示化學反應的式子。化學方程式反映的是客觀事實。因此書寫化學方程式要遵守兩個原則:一是必須以客觀...
流星劃過心悲傷
回答數:129 | 被采納數:50
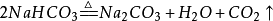 第四步:檢查化學方程式是否正確。[1] 化學方程式反應條件1.熱化學方程式寫反應條件。一般的在等號上方標記Δ。配平係數也可以不是1,可以是分數或者相互之間可以約分。2.常溫常壓下可以進行的反應,不必寫條件;但是題目中的實驗若有特定的條件,一律標注該特定條件。3.反應單一條件時,條件一律寫上麵;有兩個或更多條件的,上麵寫不下的寫在下麵;既有催化劑又有其它反應條件時,一律把催化劑寫在上麵。4.是可逆反應的一律用雙向箭頭表示。[1] 化學方程式箭頭與等號在專業領域的文獻中,不論無機、有機反應方程式中均使用箭頭號“→ ”來連接反應物和生成物。國外化學教科書、上海市中學化學二期課改教材(上海科學技術出版社2006年7月,姚子鵬主編)、2011-2012蘇教版化學書、上海高考的化學卷、理綜卷中也采用了箭頭號。但在多數省市的中學教學中,仍建議按照教材在書寫無機化學反應方程式時使用等號,以更好地表示反應中的“生成”與“質量守恒”含義。[1] 2013年中學階段無機反應方程式一律用等號連接反應物和生成物,有機反應一律用箭頭來連接反應物和生成物,是可逆反應的一律用雙向箭頭表示。[1] 化學方程式氣體符號與沉澱符號1. 氣體符號“↑”和沉澱符號“↓”是化學反應中生成物的狀態符號。隻有生成物才能使用“↑”或“↓”符號,使用時寫在相應化學式的右邊。2. 當生成物在常溫常壓下(通常指25℃、101.3kPa)是氣態的,才用“↑”號,如: 但還必須同時注意兩點:(1)若反應物中有一種或幾種氣態物質(常溫常壓下)則生成的氣態物質不再用“↑”號,如: (2)不論反應物狀態如何,隻要產物隻有一種物質,且是氣體時也不用“↑”。3. 在溶液中進行的化學反應,有難溶物質或不溶物質生成時,用“↓”號表示。如: 4. 若反應不是在溶液中進行的,就不存在沉澱析出現象,不能用“↓”號。如: 5. 對於金屬與鹽溶液之間的置換反應,生成的金屬單質,由於覆蓋在金屬的表麵,沒有沉澱析出,不應使用“↓”號,如: 6. 在複分解反應中,若生成物是微溶物時,應把它視為“沉澱”,標上“↓”。如:
第四步:檢查化學方程式是否正確。[1] 化學方程式反應條件1.熱化學方程式寫反應條件。一般的在等號上方標記Δ。配平係數也可以不是1,可以是分數或者相互之間可以約分。2.常溫常壓下可以進行的反應,不必寫條件;但是題目中的實驗若有特定的條件,一律標注該特定條件。3.反應單一條件時,條件一律寫上麵;有兩個或更多條件的,上麵寫不下的寫在下麵;既有催化劑又有其它反應條件時,一律把催化劑寫在上麵。4.是可逆反應的一律用雙向箭頭表示。[1] 化學方程式箭頭與等號在專業領域的文獻中,不論無機、有機反應方程式中均使用箭頭號“→ ”來連接反應物和生成物。國外化學教科書、上海市中學化學二期課改教材(上海科學技術出版社2006年7月,姚子鵬主編)、2011-2012蘇教版化學書、上海高考的化學卷、理綜卷中也采用了箭頭號。但在多數省市的中學教學中,仍建議按照教材在書寫無機化學反應方程式時使用等號,以更好地表示反應中的“生成”與“質量守恒”含義。[1] 2013年中學階段無機反應方程式一律用等號連接反應物和生成物,有機反應一律用箭頭來連接反應物和生成物,是可逆反應的一律用雙向箭頭表示。[1] 化學方程式氣體符號與沉澱符號1. 氣體符號“↑”和沉澱符號“↓”是化學反應中生成物的狀態符號。隻有生成物才能使用“↑”或“↓”符號,使用時寫在相應化學式的右邊。2. 當生成物在常溫常壓下(通常指25℃、101.3kPa)是氣態的,才用“↑”號,如: 但還必須同時注意兩點:(1)若反應物中有一種或幾種氣態物質(常溫常壓下)則生成的氣態物質不再用“↑”號,如: (2)不論反應物狀態如何,隻要產物隻有一種物質,且是氣體時也不用“↑”。3. 在溶液中進行的化學反應,有難溶物質或不溶物質生成時,用“↓”號表示。如: 4. 若反應不是在溶液中進行的,就不存在沉澱析出現象,不能用“↓”號。如: 5. 對於金屬與鹽溶液之間的置換反應,生成的金屬單質,由於覆蓋在金屬的表麵,沒有沉澱析出,不應使用“↓”號,如: 6. 在複分解反應中,若生成物是微溶物時,應把它視為“沉澱”,標上“↓”。如: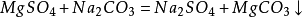 7. 必須以客觀事實為依據,即使是同一個化學反應,也必須要看具體情況。如硫化氫與二氧化硫氣體混合反應生成硫,不用沉澱符號,即: 當把二氧化硫通入到氫硫酸的溶液中時,溶液中出現了黃色的渾濁現象,生成的單質硫應標上“↓”,即 又如向氯化銀懸濁液中滴加硫化鈉溶液,白色沉澱變成黑色,發生了沉澱的轉化,生成的硫化銀應標上“↓”,即:
7. 必須以客觀事實為依據,即使是同一個化學反應,也必須要看具體情況。如硫化氫與二氧化硫氣體混合反應生成硫,不用沉澱符號,即: 當把二氧化硫通入到氫硫酸的溶液中時,溶液中出現了黃色的渾濁現象,生成的單質硫應標上“↓”,即 又如向氯化銀懸濁液中滴加硫化鈉溶液,白色沉澱變成黑色,發生了沉澱的轉化,生成的硫化銀應標上“↓”,即: 化學式在化學用語係列中,處於承上啟下的地位,前有元素符號和化合價知識,這是書寫化學式的基礎;後有化學方程式和電離方程式等,這又是以化學式為基礎的,其中如有一個化學式錯誤,則全式毫無意義,若再以這樣的錯誤化學方程式作依據進行化學計算,則錯得更遠,真可謂是“失之毫厘,差之千裏”。可見,掌握書寫化學式的要領,直接影響著其他化學用語、其他化學知識和技能的學習。
ghostxp是什麼意思? ghost能和xp合成一個詞,有點意思。不知道是菜鳥的福氣還是微軟的悲哀。 g...
GhostXP是指使用Ghost軟件做成壓縮包的WindowsXP,俗稱克隆版XP。是先預裝好後的XP製作成ghost文件。優點:安裝速度快,並可以省掉很多安裝程序。它在采...
windows xp是什麼意思呢?Windowsxp中文全稱為視窗操作係統體驗版。是微軟公司發布的一款視窗操作係統。它發行於2001年10月25日,原來的名稱是Whistler...
在Win10係統的應用商店中,很多用戶發現有一些應用以UWP標注,那麼UWP是什麼意思呢?很多用戶還不是很了解,下麵我們一起來看看。UWP應用是什麼?UWP即Wind...